中新网上海新闻6月18日电(记者于俊)肿瘤CAR-T免疫疗法的“领跑者”科济药业控股有限公司(以下简称“科济药业”,证券代码 2171.HK)18日在港交所主板以32.80港元/股上市,募资总金额约4亿美元。上市庆祝仪式同步在沪举行。

CAR-T是嵌合抗原受体T细胞免疫疗法(Chimeric Antigen Receptor T-Cell Immunotherapy)。T细胞也叫T淋巴细胞,是人体白细胞的一种,来源于骨髓造血干细胞,在胸腺中成熟,然后移居到人体血液、淋巴和周围组织器官,发挥免疫功能。其作用相当于人体内的“战士”,能够抵御和消灭“敌人”,如感染、肿瘤、外来异物等。CAR-T作为治疗肿瘤的新型精准靶向疗法,近几年通过优化改良在临床肿瘤治疗上取得很好的效果,是一种能够精准、快速、高效,且有可能治愈癌症的新型肿瘤免疫治疗方法。
全球现已上市的5种CAR-T细胞疗法均针对血液肿瘤,而对于占据肿瘤总发病率95%的实体瘤,CAR-T疗效欠佳。
科济药业创始人李宗海博士率先发表了CLDN18.2和GPC3可作为开发CAR-T疗法靶点的论文,是CAR-T细胞疗法领域的领先研究者之一。
科济药业现有自主研发管线中,除CT053、CT032、KJ-C2111之外,其余7个CAR-T候选产品均用于治疗实体瘤,其中包括CT041和CT011。CT041是全球唯一获得新药临床研究申请(IND)批件的靶向Claudin18.2的CAR-T候选产品,可用于治疗胃癌和胰腺癌等实体瘤,正被推进在中国和美国的临床试验。CT011是靶向GPC3的自体CAR-T候选产品,是中国首个获批临床的实体瘤CAR-T,也是全球首个拿到临床试验批件的GPC3 CAR-T,目前正在国内开展多中心临床I期试验,其适应症为肝细胞癌。治疗患者中有1名达到了5年无病生存。
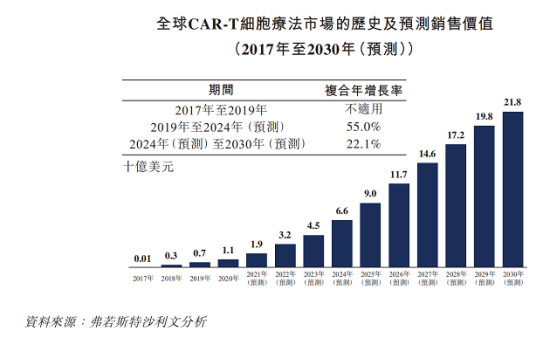
根据弗若斯特沙利文数据,科济药业已在中国、美国和加拿大获得7项CAR-T疗法的IND许可,在中国所有CAR-T公司中排名第一。
据悉,公司目前研发进展最快的是升级版靶向BCMA的CAR-T产品CT053,适应症是多发性骨髓瘤(全球第二大常见血液恶性肿瘤),已在中国进入关键II期临床试验,预计2022年上半年向中国药监局提交NDA申请。CT053在中国和美国的临床试验中体现了良好的安全性和良好的疗效,比如在中国的I期临床试验中其客观缓解率高达100%,且无一人出现严重细胞因子风暴或治疗相关死亡。CT053已获得中国突破性治疗药物品种、美国FDA再生医学高级疗法(RMAT)资格认定,欧洲药监局(EMA)的优先药物(PRIME)资格以及FDA及EMA的孤儿药产品认定。它是目前唯一获得RMAT资格的中国候选药品。
据招股书显示,科济药业于2019年在上海市建立了中国首个CAR-T细胞商业化GMP生产基地,预计每年可支持2000名患者的CAR-T治疗;2021年下半年将进行二期扩建,每年可支持多达5000名患者。此外,也已开始在美国北卡罗莱纳州建设CAR-T细胞药物商业化生产设施,以支持后续产品在美国市场的商业化上市。

关于未来的商业化策略,科济药业在招股书中表示,计划在2022年底前在中国建立一支约70人的销售及营销团队,覆盖国内重点三甲医院;努力提高美国、欧洲等主要海外市场营销团队的商业化能力,选择合适的合作伙伴,覆盖CAR-T治疗的顶级医疗机构。
基于显著的研发优势,科济药业先前已完成六轮融资。其18日在港交所发行价格为32.80港元/股,大受市场追捧,获得约434.57倍超额认购,最终募集资金总额约4亿美元(约31.08亿港元)。其中,礼来亚洲基金、新华人寿等9家投资机构获得分配约2亿美元股份,占全球发行比例约50%。(完)
注:请在转载文章内容时务必注明出处!
编辑:于俊






